



造血干细胞(Hematopoietic and progenitor cells,HSPCs)是一群具有增殖、分化和重建能力的异质性干祖细胞。造血干细胞的多样性分化对于维持外周血稳态与功能至关重要,多种血细胞分化平衡的破坏会导致贫血或恶性血液疾病。在血液形成过程中,造血干细胞是从主动脉-性腺-中肾区(Aorta-Gonad-Mesoneph,AGM)动脉腹侧生血内皮中产生,随后迁移至哺乳动物的胎肝(Feter Liver)或斑马鱼的尾部造血组织(Caudal Hematopoietic Tissue)进行快速增殖和分化,最终定植于骨髓或肾脏,维持成体造血。造血干细胞的扩增与分化受到内源性因子和周围微环境的综合调控。在稳态或应激条件下,造血干细胞如何协调其造血干性与多种血细胞分化一直是生物医学研究领域中的一个基本科学问题,相关细胞分子机制及关键因子还知之甚少。
2022年12月28日,华东师范大学生命科学学院钟涛教授团队在国际知名期刊 PNAS 上,在线发表题了Atf7ip and Setdb1 interaction orchestrates the hematopoietic stem and progenitor cell state with diverse lineage differentiation 的研究论文。该工作应用发育生物学、表观遗传学及基因组学方法揭示了 ATF7IP/SETDB1 介导的组蛋白甲基化修饰是协调 HSPC 干细胞状态与多种血液谱系分化的一个关键检测点(CHECKPOINT),用于维持红系、髓系和淋巴系等多种细胞的平衡分化及血液系统的正常循环与功能。

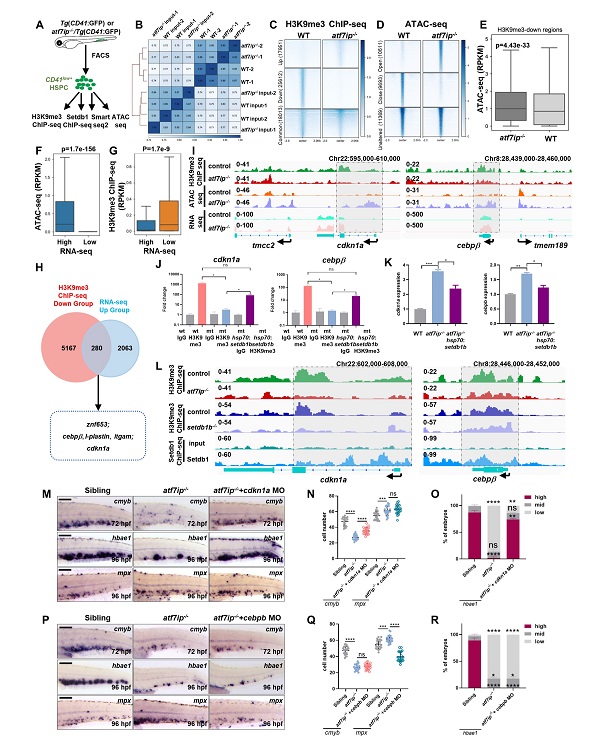
ATF7IP是一种表观调控因子,属于MCAF/AM基因家族,通过调节组蛋白甲基转移酶SETDB1核定位与泛素化,促进其H3K9甲基转移酶活性。研究人员利用CRISPR/Cas9技术构建了atf7ip和setdb1斑马鱼突变体,发现atf7ip或setdb1缺失导致造血干细胞扩增受损与髓系分化偏倚,伴随红细胞和淋巴细胞的减少。由于atf7ip和setdb1是广泛表达的表观因子,研究人员应用细胞移植、异体共生及组织特异性过表达实验,证明atf7ip/setdb1以细胞自主性方式调节造血干细胞扩增与分化。有趣的是,通过延时影像和谱系示踪技术发现,atf7ip缺失的造血干细胞在减弱增殖能力的同时提高了髓系分化潜能。通过HSPC微量ChIP-seq、ATAC-seq、RNA-seq组学分析和其他实验研究表明,敲除Atf7ip或Setdb1导致细胞周期抑制因子Cdkn1a和髓系分化关键因子Cebpb启动子区域H3K9me3沉积减少,染色质开放程度增加,引起造血干细胞扩增受阻,进而促进髓系单核细胞和中性粒细胞分化。为了进一步证明Cdkn1a和Cebpb在调控造血干细胞增殖与分化中的作用,研究人员利用吗啡啉(Morpholine)技术将Atf7ip和Setdb1突变体中的Cdkn1a和Cebpb分别敲降,结果显示Cdkn1a的缺失能部分挽救受损的造血干细胞和红系分化,而Cebpb的缺失则能抑制髓系分化偏倚。

Atf7ip缺失的造血干细胞在降低增殖能力的同时被赋予了髓系分化潜能
转座子(Transposable Elements)是真核细胞基因组的重要组成部分,如何精准调控其转座活性对于维持基因组稳定性十分重要。研究人员发现Atf7ip/Setdb1介导的H3K9me3修饰主要富集在造血干细胞DNA转座子和逆转录转座子(LTR、LINE、SINE)区域。Atf7ip与Setdb1相互作用,催化LTR和LINE调控区域H3K9me3修饰,减弱染色质开放程度,沉默LTR与LINE表达,从而抑制Mda5/Rig-I受体介导的天然免疫应答,阻滞应激驱动的过量髓系分化,以维持血液系统的正常发育与分化。为了探究组蛋白甲基化修饰在人类造血干细胞发育与分化及疾病中的作用,研究人员利用骨髓移植和集落形成实验,证明人类CD34+造血干细胞中ATF7IP缺失显著降低其造血重建能力,但保留其髓系分化潜能;同时发现ATF7IP在急性髓系白血病细胞中高表达,敲除ATF7IP/SETDB1能够抑制急性髓系白血病细胞的生长,促进髓系分化和天然免疫应答。综上所述,该研究论文揭示了ATF7IP/SETDB1介导的H3K9me3沉积和染色质重塑在控制造血干细胞扩增与多种血细胞分化中的一个重要调控机制,为人类血液疾病的干预提供了新思路和新策略。
Atf7ip与Setdb1相互作用介导组蛋白甲基化沉积和染色质重塑
华东师大生命科学学院博士研究生吴佳欣、李娟、刘国龙和同济大学生物科学与技术学院博士研究生陈康为该论文的共同第一作者,华东师大钟涛教授为本文通讯作者,东南大学谢芃研究员为共同通讯作者。钟涛教授团队的科学研究是以斑马鱼和小鼠为模式动物,结合人类干细胞,应用发育生物学、表观遗传学与基因编辑方法研究心脏、血液与血管发育分化及人类疾病发生机制。长期以来,研究成果以第一或通信作者发表在 Cell,Nature,Science,PNAS 和 NatureCell Biology 等国际顶级杂志,关于动静脉血管内皮细胞分化的重大研究成果被美国大学经典教科书《发育生物学》(第十版)采用。研究团队长期得到科技部国家重点研发计划和国家基金委项目的资助。

华东师大生命科学学院钟涛教授团队(左起李娟、钟涛、吴佳欣、陈雯琪)
附: