



CRISPR/Cas 系统因其高度的易用性与多功能性,已成为基因组工程领域的革命性工具。催化失活型 Cas 变体(dCas)进一步拓宽了该系统在基础遗传学和转化医学中的应用潜力,同时避免了 DNA 断裂所引发的基因组不稳定性风险。其中,基于CRISPR-dCas的转录激活系统(CRISPRa)正被广泛应用于疾病模型的构建和潜在的基因治疗策略开发中,是推动分子生物学和精准医学发展的重要工具。
然而,当前主流的 CRISPRa 系统多基于 dCas9 或 dCas12a,编码序列较长(约 4-5.5 kb),限制了其在腺相关病毒 (AAV)等体内递送载体中的应用,也难以满足复杂组织环境中对基因进行精准、可控调节的需求。虽有研究探索基于微型 Cas12f 的 CRISPRa 系统,但其激活效率与调控能力仍有较大局限,尚处于早期开发阶段。
针对这一挑战,2026年1月8日,华东师范大学生命科学学院、上海市调控生物学重点实验室、医学合成生物学研究中心的叶海峰团队在Nature Communications上发表题目为“A compact and inducible dCas12f-based CRISPRa platform for programmable in vivo gene activation”的研究论文。该研究成功构建了一种体积更小、激活能力更强、且调控方式灵活的dCas12f衍生转录激活平台——HEAL。该平台兼容AAV递送,具备高达十万倍级别的内源基因转录激活能力,并结合红光与小分子诱导开关,在小鼠体内实现了对疾病关键基因的可控式激活,为小型化、高效能的CRISPRa系统的开发提供了全新范式 (图1)。

▲ 我院叶海峰团队在Nature Communications上发表研究成果
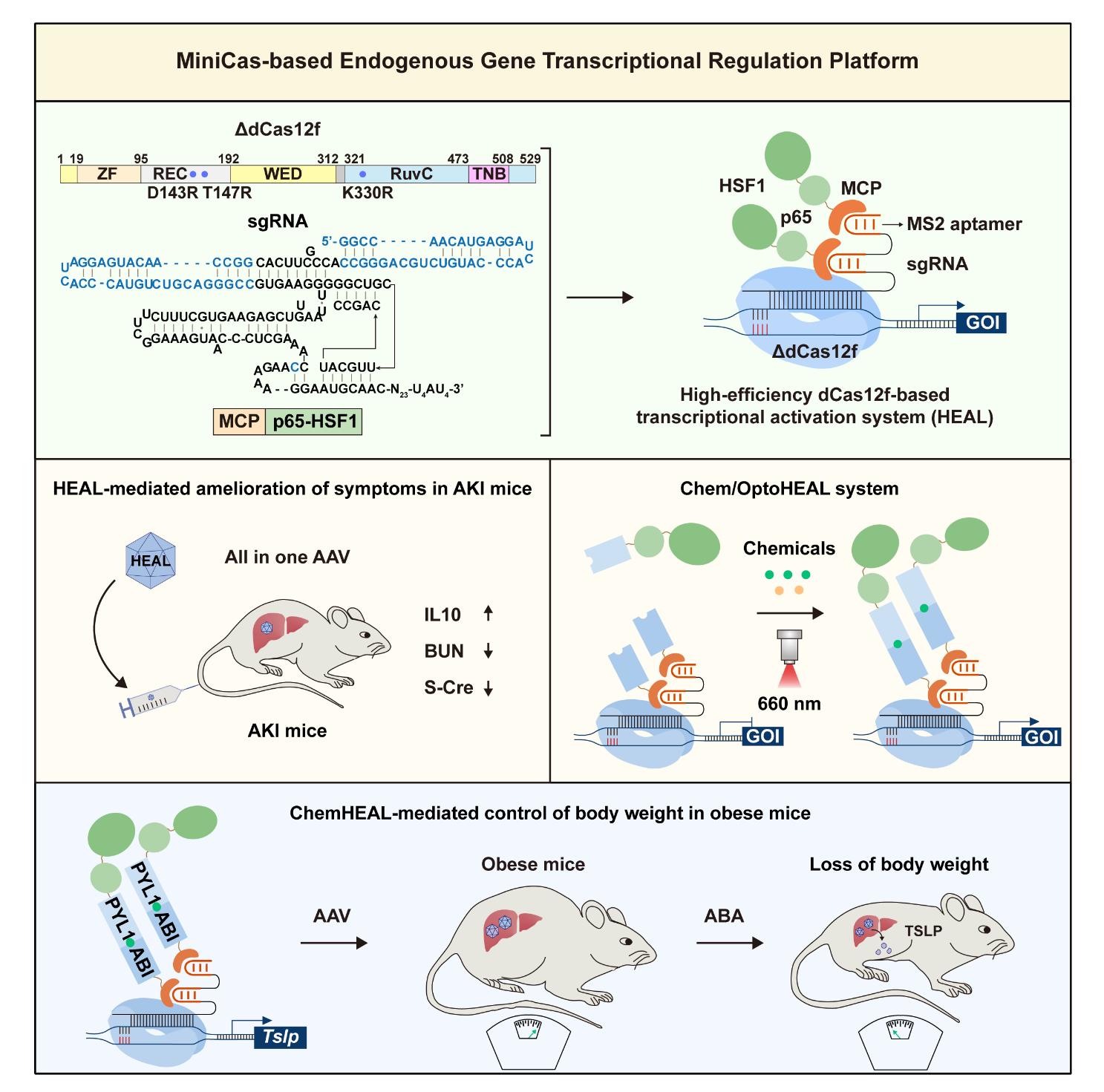
▲ 图1 HEAL系统的设计及其治疗应用
HEAL 系统的设计灵感源自微型基因编辑工具Cas12f-ge4.1,该系统基于超紧凑的 Un1Cas12f1 蛋白,适用于AAV介导的体内应用。
在此基础上,团队研究人员首先对 sgRNA 骨架进行了结构优化,嵌入噬菌体来源的 MS2 茎环结构,以高效招募与RNA结合蛋白(MCP)融合的转录激活因子(p65-HSF1)。随后,通过对 dCas12f 蛋白进行工程化改造,增强其 DNA 结合能力与核定位效率,大幅提升了系统的转录激活强度。最终构建的 HEAL系统在哺乳动物细胞中展现出超越传统 dCas9/dCas12a 系统的强大激活性能,可实现超十万倍的内源基因激活,并可通过单个 AAV 载体完成递送。
为进一步实现精准时空调控,团队基于前期开发的红光诱导REDLIP系统构建了光控HEAL系统(OptoHEAL)。该系统通过红光调控RNA结合蛋白与转录激活因子的二聚化,在哺乳动物细胞和小鼠肝脏中实现了对目标基因的光照依赖性高效激活。
为拓展应用场景、摆脱外部设备依赖,研究人员还开发了小分子诱导的HEAL系统(ChemHEAL)。通过将RNA结合蛋白和转录激活因子分别与小分子诱导的二聚化蛋白融合,成功构建了四种可由临床安全小分子调控的转录激活系统。
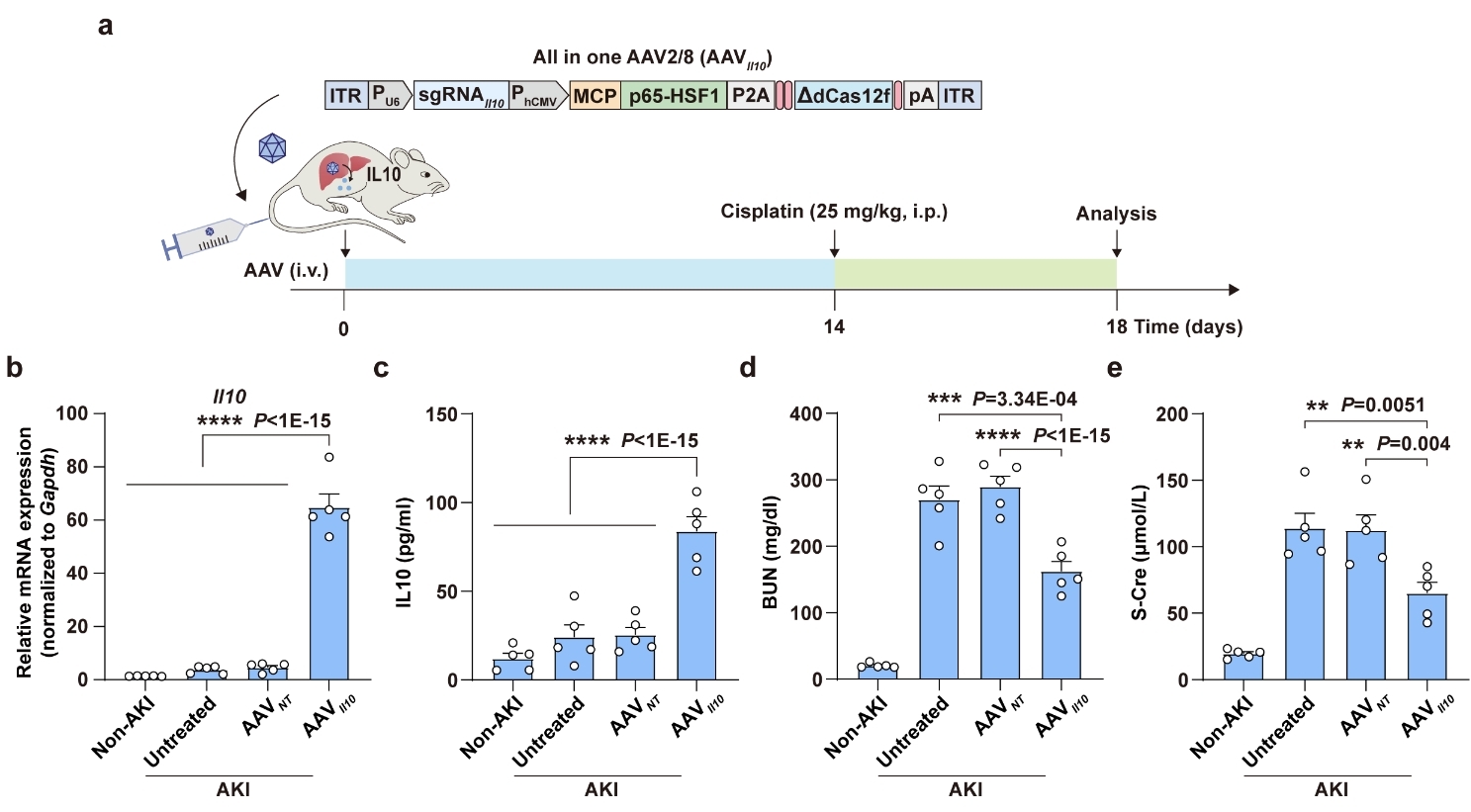
▲ 图2 单AAV递送HEAL系统缓解急性肾损伤小鼠症状
为验证其治疗潜力,研究团队利用单个AAV,将靶向Il10基因的HEAL系统递送到急性肾损伤小鼠肝脏,成功激活内源Il10的表达后,显著缓解了小鼠的肾损伤症状(图2)。
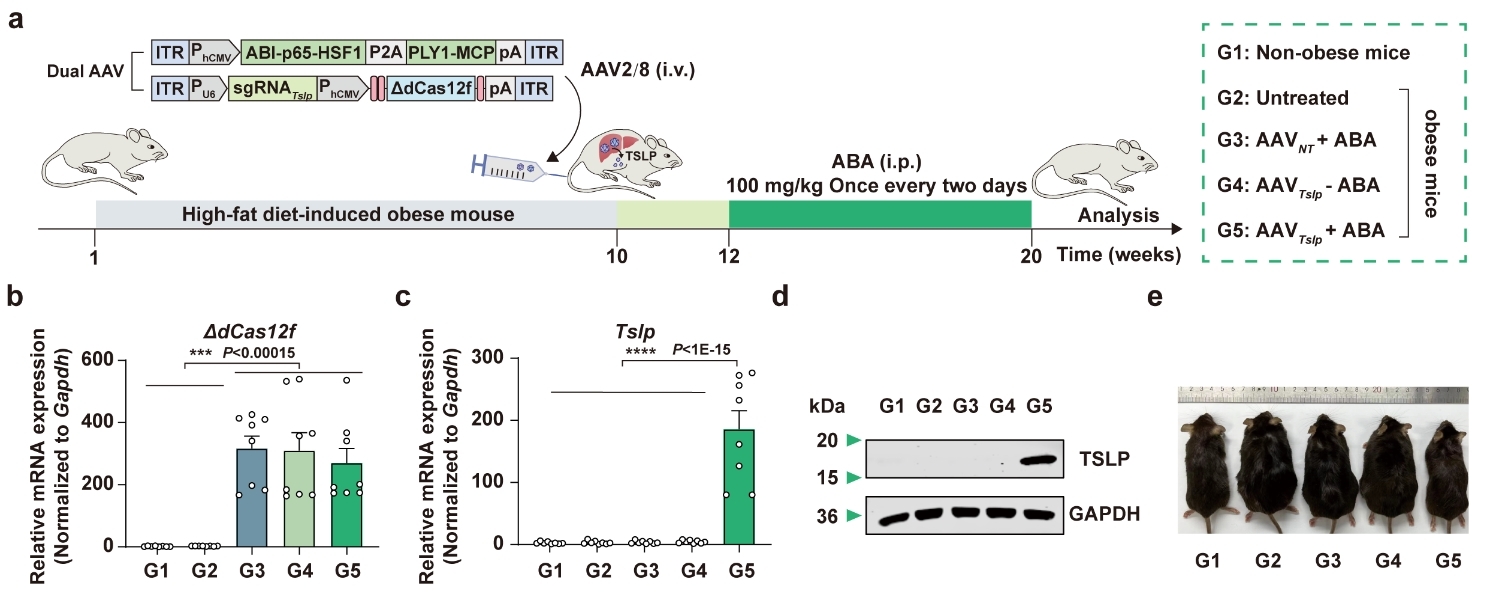
▲ 图3 ChemHEAL系统对肥胖小鼠体重的控制效果
此外,将靶向Tslp基因的ChemHEAL系统递送到肥胖小鼠肝脏中,研究实现了通过小分子药物控制Tslp表达,从而有效降低了肥胖小鼠的体重(图3)。
综上所述,本研究开发的HEAL平台作为一种微型、高效、可控的CRISPRa系统,克服了传统CRISPRa载体尺寸大、难以通过单载体AAV递送的关键限制,实现了对内源基因的高效体内激活,并可通过红光/小分子双开关进行精确调控。该平台在基因功能研究、疾病模型构建及未来精准基因治疗中展现出重要潜力,为发展下一代可控式基因治疗策略提供了有力的技术支撑。
该论文的通讯作者为华东师范大学生命科学学院叶海峰研究员和管宁子副研究员。博士研究生万航、博士后孔德强和博士研究生严涛为共同第一作者。
附: