



G蛋白偶联受体(GPCR)是细胞表面承担信号转导功能的一类膜蛋白,同时也是重要的药物靶标,以GPCR为靶标的药物占总上市药物的30%左右。以结构为基础的药物设计是药物研发的重要工具,因此,重要靶标的三维结构的解析已经成为药物研发的重要一环。然而,由于GPCR的高度动态特性并易于降解,该家族蛋白结构的解析成为结构生物学领域的难点之一。自2007年Stevens研究组与Kobilka研究组合作解析第一个人源beta2肾上腺能受体结构以来,陆续有近40个GPCR结构得到解析,但这仍然只占整个GPCR家族826个成员的一小部分。近年,引入热稳定性突变逐渐成为稳定受体蛋白并解析结构的常规手段; 但是,能够普适性地应用到GPCR的突变策略少之又少,而通过随机突变的方法既耗时又费力。
GLP-1R属于B型 GPCR中的一员,同时又是抗2型糖尿病的重要靶标之一,以该蛋白为靶点的激动剂药物每年销售额达到百亿美元以上。宋高洁研究员前期通过引入十个热稳定性突变的办法解析了GLP-1R与两个负变构调节剂的三维晶体结构(Song, et.al., 2017 Nature)。通过分析结构我们提出疑问:这十个突变是否都是结晶必需的?每种突变对结晶的作用分别是什么?这些突变的设计原理能否适用于其他GPCR或膜蛋白的突变设计?
为了回答上述问题,课题组总结了曾经设计并测试过的所有98个突变,比较了这些突变的设计逻辑和实际作用,并且将存疑的几个突变进行了回复突变并解析了相应的蛋白结构。将实验数据与分子动力学模拟相结合,发现实际形成二硫键的两个突变(I317C-G361C) 对于结晶必不可少,而另两个并未形成二硫键的半胱氨酸突变(S193C, M233C)是可有可无的。通过分析必需的突变我们发现可行的突变策略如:1)将受体锁定在特定构象;2)增加分子内或分子间(用于晶体堆积)的相互作用力;3)增强跨膜螺旋的刚性;4)加强配体-受体结合界面。从突变手段上,我们发现,通过突变以增强疏水相互作用虽然特异性较低,但由于其更灵活反而易于实现;相反,更强的相互作用力,如氢键或者二硫键,由于他们对化学键的严格几何限制,成功配对的几率也相对低。本项研究可以为GPCR和其他膜蛋白结晶提供了一般突变设计策略。同时,本文的突变思路还可以将蛋白锁定为特定的构象,为进行功能或药理研究提供新的手段。
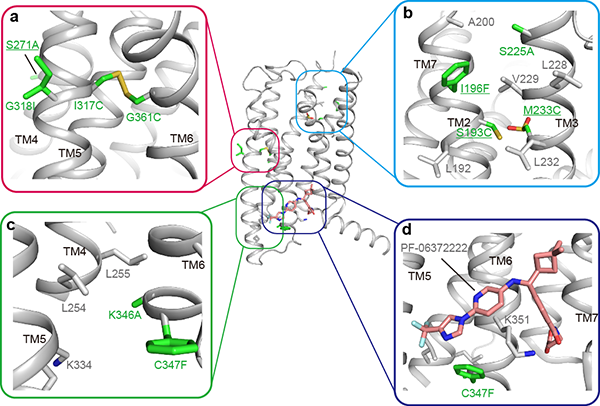
图注:十个热稳定突变在GLP-1R结构上的位置
近日,本研究的相关论文《Mutagenesis facilitated crystallization of GLP-1R》已在晶体学领域的知名期刊 IUCrJ 上发表。 宋高洁研究组的研究生徐越明、上海科技大学iHuman研究所的王玉霞工程师、北京计算科学研究中心的研究生王洋为共同第一作者,宋高洁研究员为唯一通讯作者,华东师范大学为第一完成单位。该研究还得到华东师大“双百”人才启动资金、国家自然科学基金、科技部重大专项等资金支持。
相关论文在线网址:http://journals.iucr.org/m/issues/2019/06/00/tj5027/index.html