



日前,华东师范大学生命科学学院李大力、王立人团队和上海交通大学基础医学院曾凡一课题组合作开发了三个高精准型的haA3A-CBE系列胞嘧啶碱基编辑器,在兼顾高精准度和极低脱靶活性的同时,在以往的高精度编辑器活性非常低的甲基化区域和GC序列背景位点表现出显著活性和安全性优势,并通过目前基因治疗常用的腺相关病毒(adeno-associated virus,AAV)或脂质纳米颗粒(lipid nanoparticles,LNP)递送技术,在遗传性酪氨酸血症的小鼠模型体内实现了精准高效编辑,达到治愈的疗效。
这三个高精准型的胞嘧啶碱基编辑器可以比较安全、高效且精准地去纠正一些造成遗传疾病的基因突变,有望对特定突变的遗传病彻底治愈。

华东师大生命科学学院博士生导师李大力研究员
“我们主要是对遗传病或者说基因治疗开发了一个相对更加安全和精准的基因编辑工具。”李大力研究员介绍说,如果有些遗传病是因为A:T>G:C碱基突变所致,该工具极有可能去纠正这个遗传突变进行治疗,而且理论上来说不太会产生副作用。
“主要是它的精确性比较高,将来用于临床的话,前景还不错,因为安全性不错。”李大力说道,对于安全性,他们做了大量的验证,然后也做了一些遗传病的治疗研究,这些治疗研究在小鼠遗传疾病模型里面可以看到特别好的疗效。
“我们参加了上海交通大学医学院的‘上海高水平地方高校创新团队’项目。”在上海市教委这个项目以及前沿科学基地等项目的支持下,华东师大生命科学学院李大力、王立人团队和上海交通大学基础医学院曾凡一课题组就遗传病方面的治疗开展了合作。“因为儿童医院接诊的遗传病患者比较多,他们也对遗传病的治疗比较感兴趣,双方具有天然的优势,所以合作非常顺利。虽然现在还处于临床前的基础研究阶段,我们希望将来有机会能够在临床上做一些应用。”

华东师范大学生命科学学院李大力、王立人团队
据介绍,目前已知的人类遗传疾病大部分由碱基突变引起,碱基编辑器(Base editors, BE)以其独特的作用原理,在不依赖DNA双链断裂和修复模板的条件下,可在不同类型细胞基因组中实现高效碱基转换,在基础研究和人类遗传疾病的治疗中极具应用价值。其中胞嘧啶碱基编辑器(Cytosine base editor, CBE)由胞嘧啶脱氨酶,Cas9切口酶(nickase Cas9, nCas9)和尿嘧啶糖基化酶抑制剂(uracil DNA glycosylase inhibitor,UGI)组成,可以诱导高效C-to-T碱基转换。然而,CBE的宽编辑窗口容易导致靶点内多个碱基被同时编辑,产生旁观者编辑,大大降低了编辑精度。此外,胞嘧啶脱氨酶的单链DNA和RNA结合活性易导致随机性DNA和RNA脱靶编辑,存在安全隐患。
通过蛋白改造,研究人员开发了如YE1-BE3,FE1-BE3和R33A-BE3等编辑窗口窄,脱靶活性低的精准型CBE,然而它们都是基于rAPOBEC1开发的,难以高效编辑甲基化位点和GC序列背景中的C碱基。在需要通过C-to-T碱基编辑纠正的人类致病突变中,约有43%位于CpG二核苷酸中,而哺乳动物基因组CpG中的C通常是甲基化的。基于hAPOBEC3A开发的A3A-CBE可以高效编辑此类C碱基,然而它具有很宽的编辑窗口和极高的脱靶活性,不具备编辑精确性和安全性。同样是基于hAPOBEC3A开发的eA3A-CBE具有很低的脱靶活性,并对TCR motif具有偏好性,可实现对该motif中的C的精确编辑,然而序列偏好性限制了它的靶向范围。因此,开发适用于所有序列背景的精准型CBE对基础研究和人类遗传疾病的治疗具有重要意义。
为了开发能够在多种序列背景下实现高效碱基编辑的精准型CBE,华东师大生命科学学院李大力、王立人团队和上海交通大学基础医学院曾凡一课题组的研究利用hAPOBEC3A构建了A3A-BE4max,并基于hAPOBEC3A的晶体结构进行理性设计,通过正交R-loop实验筛选低脱靶活性突变体。结果显示Y130A突变体可以在保留高编辑活性的同时,显著降低Cas9非依赖型脱靶,缩小编辑窗口,并且没有表现出固定的序列偏好性。进一步在Y130位点引入其他突变,或在Y130A基础上引入组合突变,经筛选发现Y130P和VA(I96V+Y130A)突变体在靶向编辑活性和脱靶编辑活性上保持了较好的平衡,Y130G和TA(I96T+Y130A)突变体具有最低的脱靶活性。综合考虑靶向编辑活性,脱靶编辑活性和编辑窗口,将Y130A、VA和Y130G突变体选为高精准型A3A-CBE(haA3A-CBE),分别命名为haA3A-CBE-A、haA3A-CBE-VA和haA3A-CBE-G。为了进一步评价haA3A-CBE的编辑活性和窗口,研究者在多种序列背景下对它们进行了测试。结果显示haA3A-CBE在甲基化位点的编辑活性显著高于YE1-BE4max,在GC和AC序列中的编辑效率显著高于YE1-BE4max和eA3A-BE4max,它们的高活性窗口位于protospacer的6-7位。此外,研究者通过全基因组测序和RNA测序验证了haA3A-CBE具有极低的脱靶活性。
为了评估haA3A-CBE在基因治疗中的高效性和精准性,研究者构建了9个含有人类致病SNV的细胞系。经测试发现haA3A-CBE可以高效且精确地纠正其中6个SNV,并在两个位于GC序列背景的SNV上展现出相对于YE1-BE4max 1.7-4.8倍和1.9-3.3倍的编辑效率。然而,haA3A-CBE在纠正另外3个SNV的同时引入大量旁观者编辑,研究者通过将haA3A-CBE中的nSpCas9替换为nSpCas9-NG,拓宽其靶向范围构成haA3A-CBE-NG,并通过合理设计sgRNA将旁观者C置于编辑窗口之外,大大提高了编辑精确性。为了进一步测试haA3A-CBE的基因治疗潜能,研究者通过AAV递送haA3A-CBE-G到一型酪氨酸血症小鼠肝脏,精确高效纠正了Fah基因突变的起始密码子,有效防止了肝损伤表型。然而,研究者发现随着时间的推移,旁观者编辑增加,推测是AAV递送的haA3A-CBE-G在小鼠体内长期表达的结果。随后,研究者利用LNP递送haA3A-CBE-G或haA3A-CBE-VA的mRNA和sgRNA在该小鼠体内实现了更为精确的编辑(见下图),提示了基因编辑工具瞬时性表达的重要性。
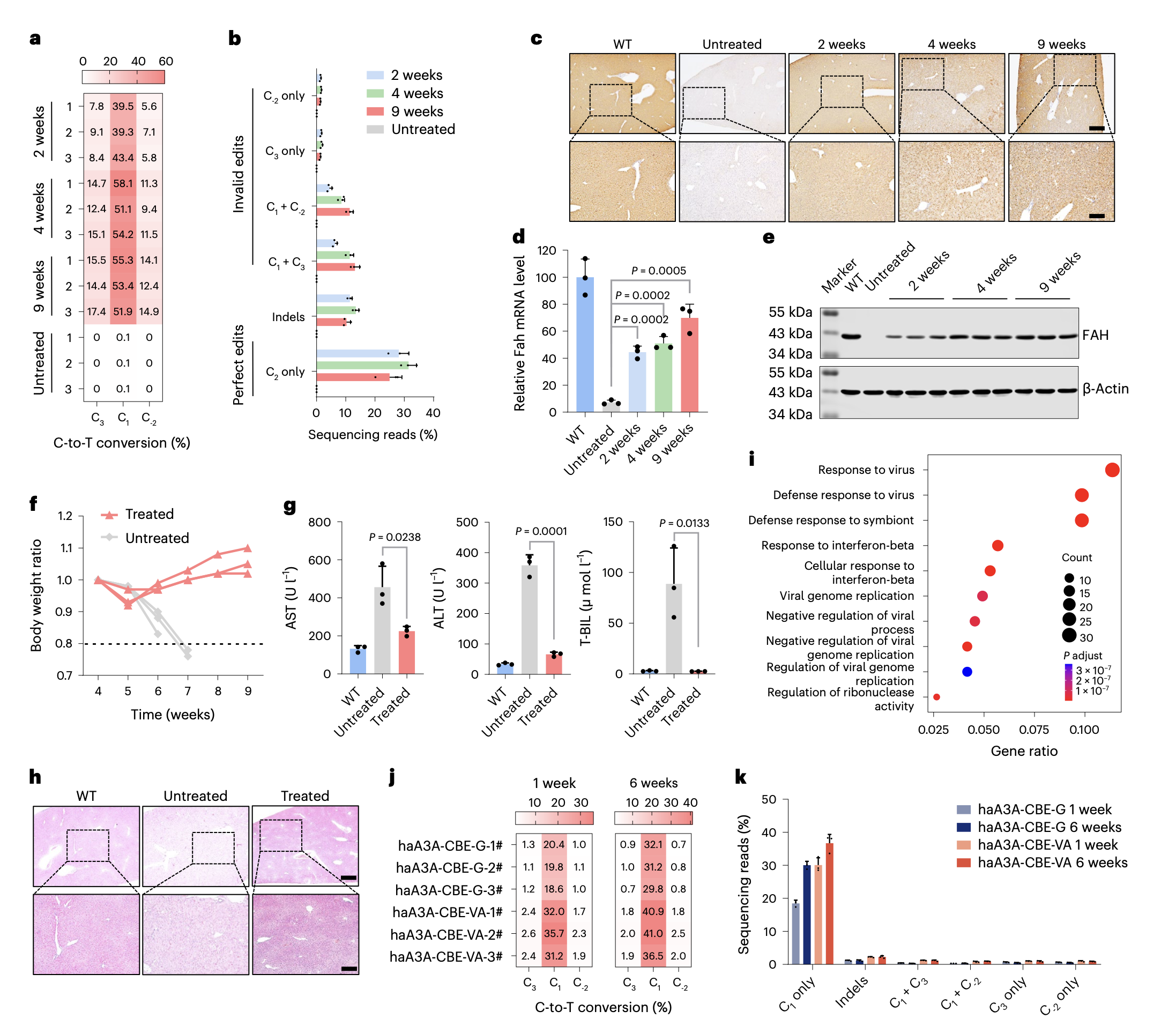
haA3A-CBE精准高效纠正一型酪氨酸血症小鼠Fah基因突变的起始密码子
总的来说,haA3A-CBE具有窄编辑窗口和极低脱靶活性,更重要的是它们能够在多种序列背景下实现高效碱基编辑,尤其是对甲基化位点和GC序列背景位点的C碱基具有高效编辑能力,丰富了碱基编辑工具箱,是治疗人类遗传疾病非常有前景的编辑器。
3月29日,华东师范大学生命科学学院李大力、王立人团队和上海交通大学基础医学院曾凡一课题组在Nature Chemical Biology杂志发表了这一研究成果。

华东师范大学李大力、王立人团队和上海交通大学基础医学院曾凡一课题组合作在Nature Chemical Biology 杂志发表研究成果

从左至右为王嫚、杨磊、霍雅楠
华东师范大学生命科学学院博士后杨磊、博士研究生霍雅楠、硕士研究生王嫚(现为东南大学博士研究生)以及博士后张丹为该论文的共同第一作者,华东师范大学为第一单位,华东师范大学李大力研究员、王立人副研究员和上海交通大学基础医学院曾凡一为论文通讯作者。华东师范大学生命科学学院刘明耀教授、宋高洁研究员、程义云教授、吕佳研究员、关玉婷研究员、北京大学伊成器教授及香港中文大学冯波教授等对该项研究提供了重要支持。该研究受到了科技部重点研发计划、国家自然科学基金、中国博士后科学基金以及上海市教委前沿科学基地和重大项目等支持。
论文链接:
https://www.nature.com/articles/s41589-024-01595-4
【新闻来源】
华东师大与上海交大合作开发高精准型胞嘧啶碱基编辑器haA3A-CBE